臨床試(shì)驗倫(lún)理審查委員會章程
一、目的
強化對藥物(wù)及(jí)醫療器械(xiè)臨床試驗的倫理管理,保證臨床試驗符合科學和倫理要求。
二、適用範圍
適用於徐州市(shì)婦幼(yòu)保健院臨(lín)床試驗倫理審查委員會的日常工作。
三、依據:
《赫爾辛基宣(xuān)言》(2013版)
《涉及人的生命科學和醫學研究倫理審查辦法》(2023版)
《涉及人的臨床研究倫理審查委員會(huì)建設指南》(2023版)
《藥物臨床試驗質量管理規(guī)範》(2020版)
《醫療器械臨床試驗質量管理規範》(2022版(bǎn))
四、規程
(一)總則
1.為規(guī)範本倫(lún)理審查委(wěi)員(yuán)會的組織和(hé)運(yùn)作(zuò),更好(hǎo)地貫徹執行國家藥品監督管理局、國家衛健委等(děng)部門的相關法律(lǜ)法規,徐州市婦幼保健院臨床試驗(yàn)倫理審查委員會修訂本章程。
2.倫理審查委員會的宗旨是通過對臨床試驗方案的科學性(xìng)、倫理合理性進行審查,確保(bǎo)受試者的尊嚴(yán)、安全(quán)和權益得到保護,促進(jìn)生命科學(xué)和醫學(xué)研究達(dá)到科學和倫理的高標準,增強公眾對臨床研究的信任和支持。
3.倫理審查委員會依法在(zài)國家食(shí)品藥品監(jiān)督管理局(jú)、所在省市的衛生健康委員會備案,接(jiē)受政府的衛生行政管理部門、藥(yào)監(jiān)行政管理部門的指導和監(jiān)督。
(二(èr))組織
1.倫理(lǐ)審查委員會名稱
徐州市婦幼(yòu)保健(jiàn)院臨床試(shì)驗倫理審查委員會(huì)
2.倫理審查委員會地址
徐州(zhōu)市和平路46號
3.組織架構
徐州市婦幼保健院臨(lín)床試驗倫理審查委員會(huì)(以下簡(jiǎn)稱倫理審查委員會)隸屬徐州市婦幼保健院。倫(lún)理審查委員會對藥物/醫療(liáo)器械臨床試驗的審查具有獨(dú)立性,工作不受任何試驗參與者的影響。其他部門及個人不得修改委員會會議最終審查決(jué)定,主任委員(yuán)不可改變委員會會議(yì)否決的決定。倫理審查委員會(huì)委員由多(duō)學科背景人員組成,共計11人,包括(kuò):醫藥專業(yè)人員、非(fēi)醫藥專業人員、法律專(zhuān)家,院外(wài)人員,其中女性(xìng)8名(míng)。醫院(yuàn)設置獨立行政建製的倫理審查委員會辦公室,確保倫(lún)理審查委員(yuán)會能夠獨立(lì)開展倫(lún)理審查工作。辦公室配備能夠勝任工(gōng)作的專職秘書和工(gōng)作人員。
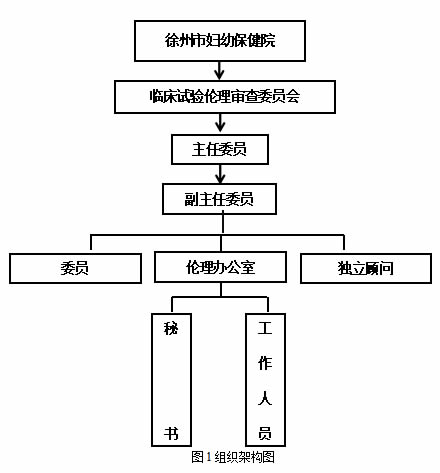
4.職責
臨床試驗倫理審查委員會對本單位承擔的以及(jí)在本單(dān)位內實施的臨床試驗進(jìn)行獨立、稱職和及時的審查。審查範圍(wéi)包括藥(yào)物(wù)臨床試(shì)驗項目(mù),醫療器械臨床試驗項目等。倫理審查委員會辦(bàn)公室負(fù)責倫理審查委員會日常行政事務的管理工作,倫(lún)理(lǐ)審查委員會設倫(lún)理(lǐ)秘書。
5.權(quán)利
倫(lún)理審查委員會有權同意/不同意一(yī)項臨床研究,對同意的臨床研究進行跟蹤審查,終止(zhǐ)或暫停已經同(tóng)意的臨床研究(jiū)。
6.行政資源(yuán)
醫院為倫理審查委員會提供獨立的辦公室,必要的辦公條件,包括文件櫃、電腦、複印機、傳(chuán)真機,有可利用的檔案室和會議室,以滿足(zú)其職能的需求。醫院任命足夠數量的倫理委員,以滿足倫理審查委員會工作的需求。醫院為委員、獨立顧問(wèn)、秘(mì)書與工作人員提供充分的培(péi)訓,使其能夠勝任工作。
7.財政資源
醫院為倫理審查委員會正常開展工作提供(gòng)經費,倫理審查委員會(huì)的(de)行政經費列(liè)入(rù)醫院財政預算。經費使用按照醫院財務管理規(guī)定執行,可應要求公開支付給委員的勞務費。
(三)組建與換屆
1.委員組成
倫理審查委員會(huì)委員的組成(chéng)和數量應與所審查項目的專業類別和(hé)數量相符。倫理審查委員(yuán)會的委員類別包括醫藥專業、非醫藥(yào)專業、與研究項目的組織者和研究機構(醫院(yuàn))不存(cún)在行政(zhèng)隸屬關係的(de)外(wài)單位的人(rén)員(yuán)、法律專家、醫學倫理學專家,並有不同性別的委(wěi)員,且(qiě)全(quán)體委員人(rén)數不少於7人。臨床試驗機構(gòu)主(zhǔ)任/院長(zhǎng)不兼任(rèn)倫理審查委員會委員。
2.委員的招募/推薦
倫理審查委(wěi)員會(huì)采用公開招募的方式,結合有關各方的推薦並征詢本人意見,形成委員候選人名單。應聘者應能保證(zhèng)參加培訓,保證有足夠的時間和精力參加審(shěn)查工作(zuò)。
3.任(rèn)命的機構與程序
醫院(yuàn)辦公室負責倫理審查委員會(huì)委(wěi)員的任(rèn)命事項。倫理審查委(wěi)員會組成人員以醫院正式文件的方式任命。接受任命的倫理審查委員會委員(yuán)應參(cān)加GCP、倫理審查的初始培訓和繼續(xù)教(jiāo)育;提交本人簡曆、資質(zhì)證明文件,GCP培訓證書;同意並簽(qiān)署利益衝突聲明,保(bǎo)密承諾,並同意公開自己的姓名、職業和隸屬機(jī)構,同意公開與參加倫理審查工作相關的交通、勞(láo)務等補償。
4.負責人設置
倫理審(shěn)查委員會(huì)設主(zhǔ)任(rèn)委員(主委)1名,副主(zhǔ)任委員(副主委)1名。主委和副主委由委員選舉產生,並經醫院院辦公室任命。主委負責(zé)主持審查會議,審簽會議記錄,審簽決定文件(jiàn)。主委與其(qí)他委員之間不是管理與被管理的關係。主委因故不能履行職責時,可以委托副主委履行主委全部(bù)或部分職責。
5.任期
倫理審查委員會每屆任期3年,可以連任。
6.換(huàn)屆
換(huàn)屆應考慮保證倫理審查委員會工作(zuò)的連續性(xìng),審查能力的(de)發(fā)展,以及委員的專業(yè)類別。換屆後醫藥專業背景的委員不少於1/3;應有部分委員留任,以保證倫理審查委員會工作的(de)連續性;換屆候選委員采用公開招募、有關各(gè)方和委員推薦的(de)方式產生,倫理審查委員會直接聘任。
7.免職
以下(xià)情況可以免去委員資格(gé):本人書麵申請辭去委員職務者;年度因各種原因缺席1/3以上倫理審查會議者;因健康或工作調離等原因,不能繼續履行委員職責者;因行為道德規範與委員職責相(xiàng)違背(如與審(shěn)查項目存在(zài)利益衝突而不主動聲明(míng)),不適宜繼續擔任委員(yuán)者。
免職程序:委員可以向主任委員遞交辭呈。主任委(wěi)員收受辭呈(chéng)後,經與委員洽(qià)談,確認並同意委員辭呈後,呈報院(yuàn)領導,免職決定以醫院正式文(wén)件(jiàn)的方式公布。
8.獨立(lì)顧問
如果委員專業知識不能勝任某臨(lín)床試驗的審查,或某臨床試驗的受試者與委員(yuán)的社會與(yǔ)文化背景明顯不同時,可以聘請獨立顧問。這些(xiē)專家可以是倫(lún)理或法律方麵的、特定疾病或方法(fǎ)學的專家,也(yě)可(kě)以是社區、病人或特定利益團體的代表。獨立顧問應提交本人(rén)簡曆、資質證明文件,簽署保密承諾與利益衝突聲(shēng)明(míng)。獨立顧問應(yīng)邀對臨(lín)床試驗的某方麵問題(tí)提供谘詢意見,但不具有表決權。
(四(sì))運作
1.審查方式
倫理審查委員會的審查(chá)方式有會(huì)議審查,緊急會議審查,快速(sù)審查,應急審查。實行(háng)主審製,為每個審查項目安排主審委員,填寫審查工作表。
會議審查是倫理審查委員會主(zhǔ)要的審查工作方式,每月的第(dì)三周中的一個工作日例(lì)行召開(kāi)審查會議。委員在會前預審送審項目。研究過(guò)程中出現重大或嚴重問題,危及受試者安全,應召開緊急會議審(shěn)查。
快速審(shěn)查是會(huì)議審查(chá)的補充形式,目的是為了提高工作效率,主要適用於(yú)以下情況:受試者風(fēng)險不大於最(zuì)小風險,且不涉及弱勢(shì)人群和個(gè)人隱私及(jí)敏感性問題;已同意方案的較小修正(zhèng),不影響研究風(fēng)險受益比;尚未納入受試者且未發現額外風險;不屬於增加(jiā)受試者風(fēng)險或顯著影響(xiǎng)臨床試驗的非預期問題;倫理審查(chá)提出的明確或(huò)較小意見的修改,倫理審查委員會為了驗證這些修改。
2.法定人數(shù)
到會委員人數應超(chāo)過半數成(chéng)員並不少於6人;到會委員(yuán)應(yīng)包括醫藥專業、非醫藥專業、獨立於研究實施機構(gòu)之外的委員,並有不同性別(bié)的委員。
3.審查決定
送審文件齊全,申(shēn)請(qǐng)人、獨立顧問(wèn)以及與研究項目存在利益衝突的委(wěi)員離場,投票委員符合法定人數,按審查(chá)要素(sù)和審查要(yào)點進行充分的審查討論後,以投票的方(fāng)式做出決定;沒(méi)有參與會議討論的委員不能投票。倫理審查以(yǐ)超(chāo)過全體委員半數票的意見作為審查決定。會後及時(不超過5個工作日)傳達審查決定或意見。研(yán)究者、或研(yán)究利(lì)益相關方對倫理審查委員會的審查決定有不同意(yì)見,可以提交複審(shěn),或與倫(lún)理審查委員會委員和辦公室溝通交流。
4.利(lì)益衝突管理
遵循利益衝突(tū)政策,與研究項目存在利益衝突的委(wěi)員/獨立顧(gù)問應主動聲明並退出該項目審查的討論和決定程序。倫理審查委員會(huì)應審查研究人員與研究項(xiàng)目之間的利益衝突,必要時采取限製(zhì)性措施。
5.保密
倫理審查委(wěi)員會委(wěi)員/獨立顧(gù)問對送審項目的文件負(fù)有保密責(zé)任和義務,審查完成後,及時交回所有送審文件與(yǔ)審查材料,不得私自複製與外傳。
6.各部門協作
醫(yī)院所有與受試者保護的相關部門應協同倫理審查委員會工作,明確各自在倫理審(shěn)查和研究監管中的職責,保證本醫院承擔的以及在本醫(yī)院內實施的所有涉及人的臨床試驗(yàn)均(jun1)提交倫理審查,受試者的健康和權益得到保護;保證(zhèng)開展(zhǎn)臨床試驗中所涉及的組織機構利益衝突、委員和研究(jiū)人(rén)員的個人利益衝(chōng)突得到最大限度的(de)減少或消除;有效的報告和處理違(wéi)背法規與(yǔ)方案的情況;建立與受試者、研究者或研究利益相關方有效的(de)溝通渠道,對其所關心的問題和訴求做出回應。倫(lún)理審查委員會應建立(lì)與其(qí)他機(jī)構倫理審查委員會有效的溝通交流機製,協作完成多中(zhōng)心臨(lín)床研究的倫理審查。
7.質量管理
倫理(lǐ)審查委員會接受衛生行政部門(mén)、藥品監督管理部門的監督管理;接受(shòu)獨立的、外部的質量評估或認證。倫理審查委員會對檢(jiǎn)查發(fā)現的問題采取相應(yīng)的改(gǎi)進措施。